¿Por qué la escala de pH no es lineal?
ACTIVIDAD
-
Lee atentamente:
Titulación
Titulante
Titulado
Titulado
La
concentraciónTitulado
Bureta
Indicador
Matraz
Punto de
equivalenciaNeutralización
ácido - baseVbNb = VaNa
Interviene Puede ser Se conoce Se desconoce Puede ser Se encuentra Se le agrega
Titulante = Titulado
eq-gr de la base = eq-gr del ácido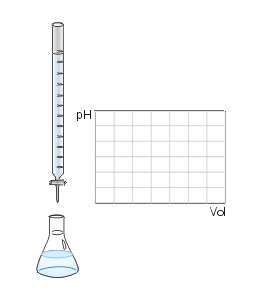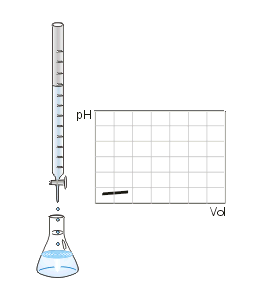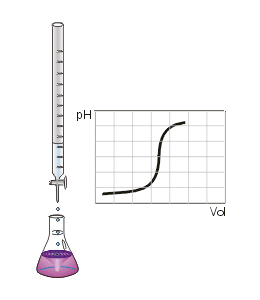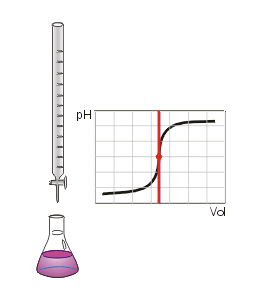
-
Lee atentamente:
Hay varias clases
de neutralización
ácido-base, las
veremos a
continuaciónBase fuerte - ácido fuerte
Base fuerte - ácido débil
Base débil - ácido fuerte
-
Lee atentamente:
Base fuerte - ácido fuerte
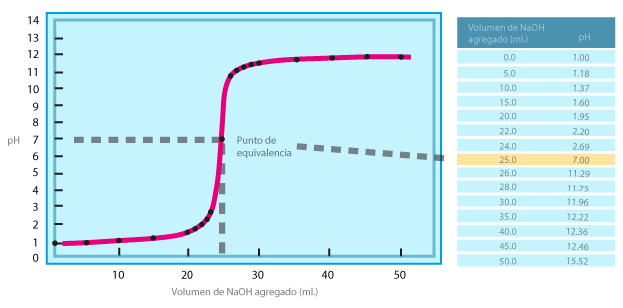
Allí el punto de equivalencia tiene un pH de 7
Explicación
NaOH + HCl → NaCl + H2O
en función de la ecuación iónica neta
H+(AC) + OH(AC) → H2O -
Lee atentamente:
Base fuerte - ácido débil
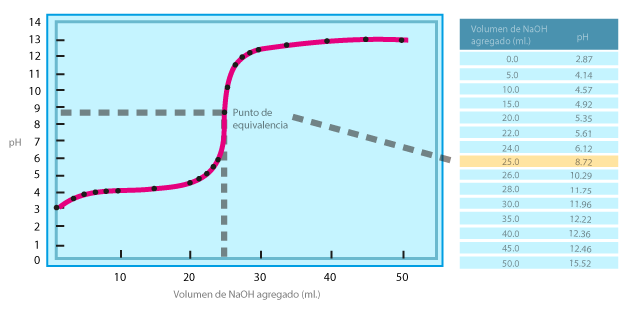
Allí el punto de equivalencia tiene un pH de 8.72
CH3COOH + NaOH → CH3COONa + H2O
esta reacción se reduce a:
CH3COOH + OH → CH3COO+ H2O
el ion de acetato se hidroliza de la siguiente forma
CH3COO + H2O CH3COOH + OH-
Por tanto, en el punto de equivalencia, cuando solo
hay iones de acetato, el pH es mayor de 7 por el
exceso de iones de OH-→
← -
Lee atentamente:
Base dédil - ácido fuerte
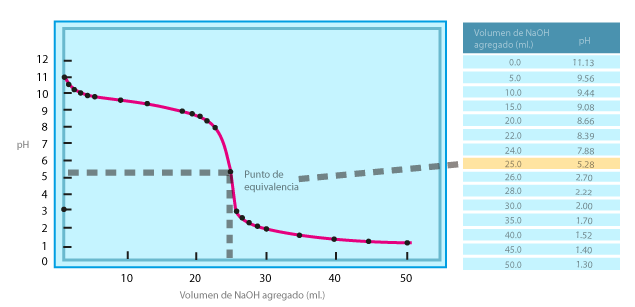
Allí el punto de equivalencia tiene un pH de 5.28
HCl + NH3 → NH4
en función de la ecuación iónica neta
H+ + NH3 → NH4
NH4+ + H2O NH3 + H3O→
← -
Lee atentamente:
1. ¿Qué diferencias observaste entre las neutralizaciones vistas?
2. ¿Qué es el punto de equivalencia?
3. ¿Cuál es la diferencia entre el punto de equivalencia
y el punto final?
4. Para encontrar la concentración de un ácido se titula 25 ml de
el con una base estándar. ¿Cuál es la concentración del ácido si
se gastaron 35 ml de la base estándar cuya concentración era de
1,256N? Rta= 1,75N
-
En los tubos tienes
ácido y una base.
Añade una gota de
tornasol para saber en
donde está el ácido. -
Para comprobar el
carácter ácido o básico
de disoluciones de abajo
introduce en ellas
una tira de papel
impregnada en tornasol -
Observa
-
Clasifica las distintas disoluciones en ácidos y bases.
ÁCIDOS



BASES









-
Determinación de la molaridad de una solución
En el laboratorio
y con ayuda del
material del
estudiante realiza
esta práctica