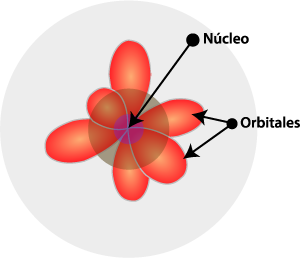
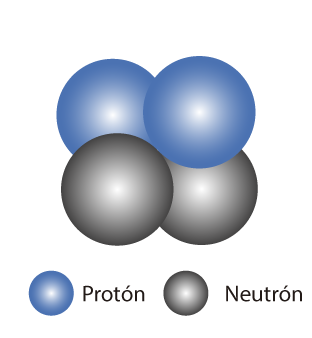
Observa con atención la información del estudio de los modelos atómicos a través de la historia. Haz clic en cada cuadro para acceder a la información correspondiente:
Demócrito
Dalton
Thomson
Rutherford
Bohr
Lewis
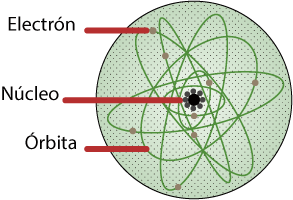
Sommerfeld
Schrödinger
Pon a prueba tus conocimientos. Arrastra la figura del modelo atómico al personaje que corresponde.


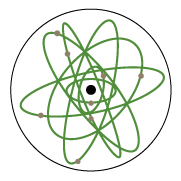
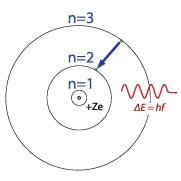
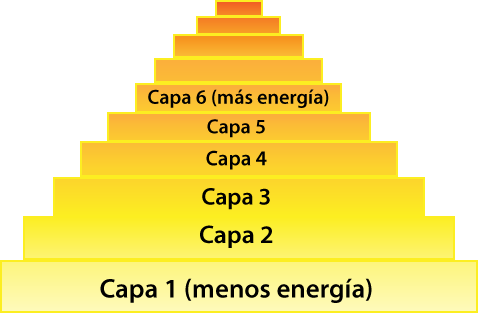
Observa La Configuración del modelo atómico moderno. Da clic en cada botón para acceder a la información:
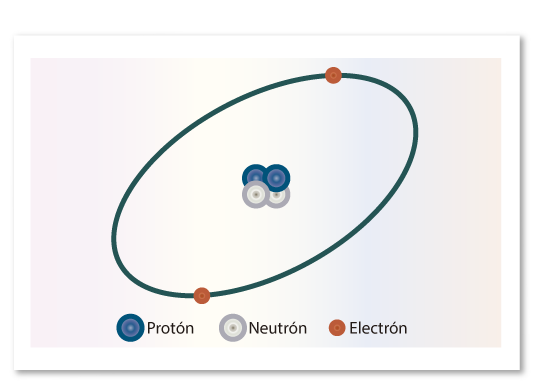
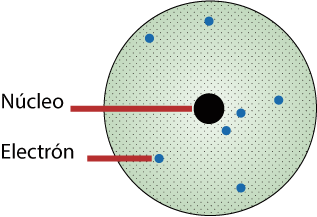
En el átomo se distinguen dos partes:
Ahora que ya viste la información sobre configuración de una átomo, ¿sabes cómo se encuentran distribuidos los electrones dentro de un átomo?
Soluciona en tu material.
Ahora te invitamos a realizar esta actividad. Necesitaras de los siguientes elementos:



Cartón
30 semillas de frijol
30 semillas de maíz



30 semillas de arveja
Tijeras
Pegante
Procedimiento:
Toma el cartón, traza y recorta cinco círculos.


Procedimiento:
3. Une todos los círculos teniendo como referencia el primero que recortaste. Al final debes tener una figura, así:
4. Toma las semillas de fríjol, maíz y arveja. Diferéncialos con los siguientes nombres (no importa el orden)

Protones

Protones

Protones

Procedimiento:
5.Según tus conocimientos, ¿dónde ubicarías cada semilla?

 Neutrones
Neutrones
 Electrones
Electrones
 Protones
Protones
Da clic en cada una de las flechas para ver la información.
Haz clic para observar el video, Tabla periódica y números cuánticos.
De acuerdo con el video de tabla periódica y números cuánticos. Completa con tus ideas el cuadro de los número cuánticos en tu material y compara tus respuestas:
| Números cuánticos | Representa y valores |
|---|---|
| n: número cuántico principal | |
| l: número cuántico del momento angular o secundario | |
| m: número cuántico magnético | |
| s: número cuántico del espín electrónico. |
Haz clic en cada icono para observar la información correspondiente:




Haz clic en cada icono para observar la información correspondiente:
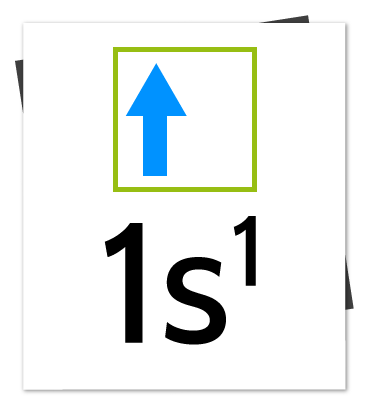


Observa a continuación la representación de la configuración electrónica del oxígeno:
Da clic en cada cuadro verde para observar como se ubican los electrones:





Haz clic para observar el video de configuración electrónica de los elementos químicos:
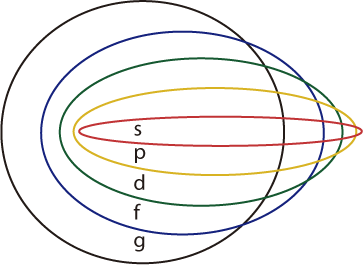
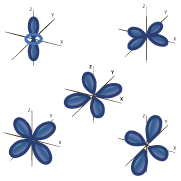
La distribución electrónica de los orbitales tiene una relación directa en la tabla periódica de la siguiente forma.
Ahora vamos a tomar la representación de átomo que realizamos: señala y nombra en el material del estudiante con diferentes colores a los niveles, subniveles y número máximo de electrones.

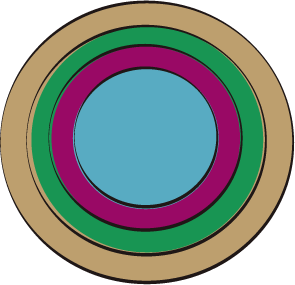

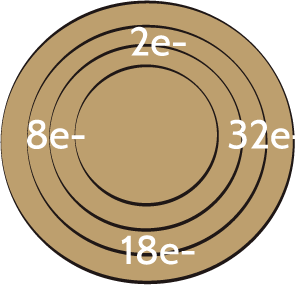

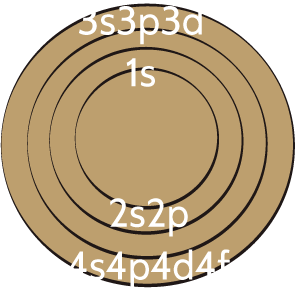
Utilizando la representación que realizaron del átomo, ahora describamos la distribución electrónica del sodio (Na).

Na (Sodio) Número atómico:
Configuración electrónica y diagrama de los orbitales:
Reúnete con dos compañeros y tomando la representación que realizaron del átomo, describe la distribución electrónica de los siguientes elementos utilizando las semillas.
Haz clic en cada elemento para ver las respuestas correctas: